Welche Antihypertensiva schützen am besten vor Herz-Kreislauf-Komplikationen?
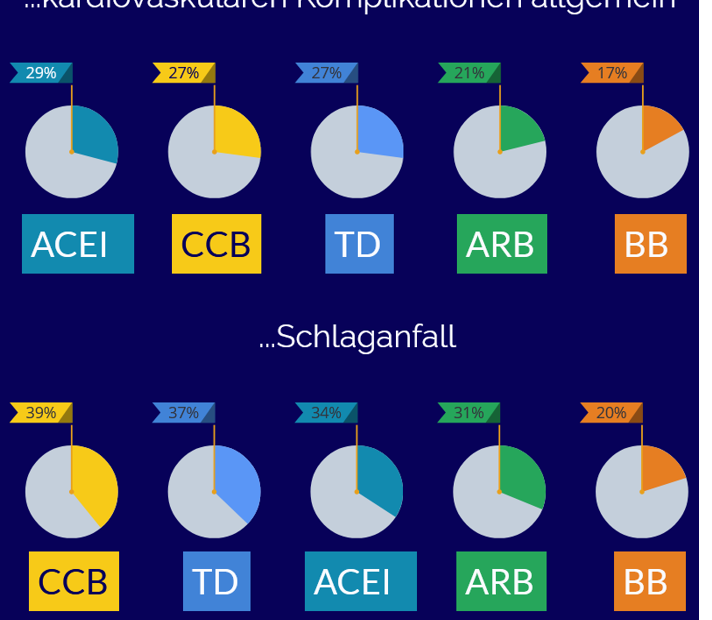
Ein systematischer Review [1] zeigt, dass ACE-Hemmer (ACEI), Dihydropyridin-Calciumkanalblocker (CCB), und Thiaziddiuretika (TD) in den ausgewerteten Studien ähnlich wirksam waren: Sie senkten das relative Risiko für kardiovaskuläre Ereignisse insgesamt (25%), tödliche kardiovaskuläre Ereignisse (20%) und Schlaganfälle (35%). Außer den drei Gruppen waren auch Betablocker (BB)… Weiterlesen »Welche Antihypertensiva schützen am besten vor Herz-Kreislauf-Komplikationen?